Skrevet af: Ellen Askholm, sygeplejerske, stråleterapeut og stud.cand.scient.klinisk videnskab og teknologi og Katrine Lærke Hedemand Poulsen, intensivsygeplejerske og stud.cand.scient.klinisk videnskab og teknologi.


Abstract
Ernæringsterapi og glykæmisk kontrol hos intensivpatienter var kompleks og blev reguleret af forskellige uafhængige instrukser. Ved hjælp af en systematisk litteratur gennemgang, blev det undersøgt hvordan sammenhængen mellem ernæringsterapi og glykæmisk kontrol kunne sikres hos intensivpatienter ved hjælp af modelbaserede beslutningsstøtteværktøjer. Her viste to modelbaserede beslutningsstøtteværktøjer lovende resultater, i forhold til at kunne give patientspecifik rådgivning til behandlingspersonalet om både ernæringsterapi og glykæmisk kontrol. Inden der træffes beslutning om at implementere beslutningsstøtteværktøjer, var det hensigtsmæssigt, ved hjælp af en teknologivurdering at undersøge værktøjet ud fra Behandlingsrådets fire aspekter.
Baggrund
Kompleksiteten i plejen af intensivpatienter, er stigende grundet flere behandlings- og monitoreringsmuligheder. Monitoreringsteknologierne der anvendes i plejen og behandlingen af intensivpatienter bidrager til en stigende informationsmængde, der kan være svær for læger og sygeplejersker at bevare overblikket over, og dermed udnytte til at optimere og individualisere plejen og behandlingen af patienten (1,2). Det er samtidig afgørende for udfaldet af behandlingen, at læger og sygeplejersker hurtigt opdager ændringer i patientens tilstand og reagerer adækvat på disse ændringer (1). Der udvikles derfor et stigende antal beslutningsstøtteværktøjer, til anvendelse hos intensivpatienter (2). Målet er, at disse værktøjer vil kunne vejlede i at træffe hurtige og sikre beslutninger i behandlingen af patienterne, samt hjælpe i prioriteringen af de livsvigtige opgaver og bidrage til forebyggelse af komplikationer (2).
Ernæringsterapi og glykæmisk kontrol
Omkring halvdelen af patienter i behandling på intensivafdeling udvikler stressinduceret hyperglykæmi indenfor de første to døgn, også selvom de ikke er diagnosticeret med diabetes (3) se Figur 1. Stressinduceret hyperglykæmi blev anerkendt som en alvorlig tilstand, der kunne påvirke udfaldet af kritisk sygdom, efter at et stort randomiseret studie i 2001 viste øget mortalitet og øget risiko for infektioner hos patienter, hvor der først blev interveneret mod blodsukre over 11,9 mmol/L (4).
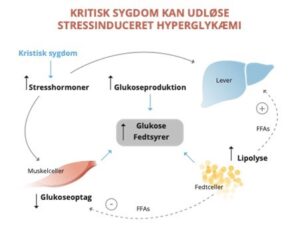
Ernæringsterapi til intensivpatienter er en fundamental del af behandlingen, da kroppens celler har behov for energi for at kunne fungere, og de er sjældent i stand til selv at indtage den energi, kroppens celler har behov for (6). Potentielle konsekvenser ved fejlernæring er blandt andet nedsat immunforsvar, længere hospitalsophold, øget mortalitet og morbiditet, længere behov for respiratorbehandling, muskelsvaghed samt behov for længere tid til genoptræning (6).
Da både ernæringsterapi og glykæmisk kontrol til intensivpatienter er kompleks og patientafhængig, kan den mest optimale behandling, være vanskelig at identificere. Intensivafdelingernes lokale instrukser for ernæringsterapi, glykæmisk kontrol og insulinadministration, skal fungere som arbejdsredskaber for læger og sygeplejersker, og sikre patienterne den bedst mulige opnåelse af både glykæmisk kontrol og ernæringsmål. (7)
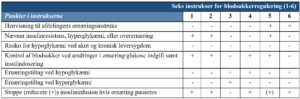
Der blev i forbindelse med dette projekt fremsøgt lokale instrukser fra seks forskellige intensivafdelinger i Danmark, for at undersøge på hvilken måde ernærings- og blodsukkerinstrukserne var integreret. Ved gennemgang af seks ernæringsinstrukser, se Tabel 1 (8–13) var der to der henviste til den lokale blodsukkerinstruks (10,12). Tre ud af seks ernæringsinstrukser nævnte risiko for insulinresistens (10,12,13). En definerede, hvornår der var tale om insulinresistens og vejledte i valg af ernæringsprodukt i forhold til glykæmisk kontrol (10). Det fremstod ikke klart, hvornår der skulle øges i insulindosering pga. hyperglykæmi eller modsat reduceres i tilførslen af kulhydrater.

Af lokale instrukser for blodsukker/insulinadministration fra de seks intensivafdelinger, (se Tabel 2)(14–23) blev der i instrukserne på to afdelinger henvist til afdelingens ernæringsinstruks (14,24). En afdeling anviste reduktion af ernæring ved hyperglykæmi (19,20), på tre afdelinger blev der anvist at opstarte ernæring ved hypoglykæmi (19–24). Ingen af instrukserne for blodsukker/insulinadministration nævnte opmærksomhed på risiko for hypoglykæmi ved leversygdom. Der sås generelt en varierende grad af kompleksitet i instrukserne, hvor både anbefalingerne til blodsukkermonitorering og insulinadministration var forskellige mellem afdelingerne.
Formål
Instrukserne fra de seks afdelinger viste ikke en sammenhængende behandlingsindsats for ernæringsterapi og glykæmisk kontrol. Derfor var formålet med artiklen at belyse på hvilken måde modelbaserede beslutningsstøtteværktøjer, i form af computerprogrammer, kunne rådgive om både ernæringsterapi og glykæmisk kontrol til intensivpatienter, således den mest optimale kombination blev givet ud fra patientspecifikke informationer.
Metode
Litteratursøgning
Litteratursøgningen blev opbygget som en bloksøgning i tre databaser Embase, PubMed og CINAHL. Den bestod af fire blokke. Blok 1 omhandlede patienter indlagt på intensivafdeling. Blok 2 skulle afdække ernæring og ernæringsterapi. Blok 3 omhandlede glykæmisk kontrol og behandling. Blok 4 blev medtaget for at få afdækket forskellige værktøjer til vejledning af behandlingen, se Tabel 3.

Der blev opsat in- og eksklusionskriterier, der skulle sikre afdækning af relevante artikler for problemstillingen.
Resultater
Modelbaserede beslutningsstøtteværktøjer
Ved gennemgang af den fremsøgte litteratur, var der primært to modelbaserede beslutningsstøtteværktøjer, der kunne give rådgivning om både ernæringsterapi og glykæmisk kontrol ved behandling af intensivpatienter. Der blev gennemgået 10 studier af Glucosafe (GS) modellen (25–34) og 14 studier af ’Stochastic TARgeted’ (STAR) modellen (35–48) begge modeller viste sig testet, valideret og modificeret i disse studier.
Både STAR og GS tager udgangspunkt i insulin-ernæring-glukose metabolisme modeller, der kombineret med patientspecifikke data kan forudsige blodsukkerværdier, og på den baggrund rådgive om både ernæringsterapi og glykæmisk kontrol. Modellerne kan beregne et interval af blodsukkerværdier en, to og tre timer frem i tiden, og derudfra foreslå den mest optimale kombination af ernæringsterapi og insulinindgift (30,46).
- Programmerne er endnu ikke CE-mærket, og derfor ikke kommercielt tilgængelige, til klinisk anvendelse.
- Patientspecifikke data er blandt andet højde, vægt, alder, køn, graden af kritisk sygdom, APACHE II score, ernæringsberegning, evt. indirekte kalorimetri, hæmodialyse, diabetes og type.
- Det er hensigten, at programmet kan kommunikere med elektroniske patientjournaler og ‘patient datamanagement systemer’ (PDMS), således ekstra indtastninger kan undgås. Muligvis også pumperne, men programmet vil ikke automatisk ændre på dosis/hastigheder, der skal en menneskelig handling til før rådgivningen udføres.
- Programmet kan tilpasses afdelingens retningslinjer for ernæring og blodsukkerregulering.
STAR-modellen blev implementeret på intensivafdelinger i New-Zealand i 2011 (45), Ungarn i 2011 (45), Malaysia i 2018 (41) og Belgien i 2019 (38). Den blev i flere studier vist effektiv, til at opnå blodsukre indenfor det interval afdelingen eller studieprotokollen havde defineret (36,41,44). Ligesom der ved sammenligning af resultaterne fra STAR studierne og data fra et stort ernæringsstudie af 158 intensivafdelinger i 20 lande (49), viste sig at STAR-modellen præsterede at opnå ernæringsmålene svarende til de bedste intensivafdelinger i studiet af Cahill et al. (50). STAR-modellens brugerflade blev udviklet og testet i tæt samarbejde med det kliniske personale, der var således fokus på en let og sikker anvendelse af computerprogrammet (39,40).
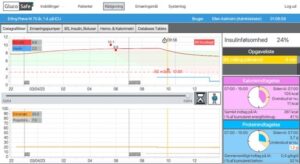
GS-modellen er ikke implementeret i klinisk praksis, men er aktuelt under afprøvning i et klinisk randomiseret kontrolleret studie (RCT) (51). I et studie af GS-modellens brugerflade, se Billede 1, angav 85% af brugerne, at de troede værktøjet ville kunne øge tendensen til at følge instrukserne og bidrage til en standardiseret pleje af patienterne. Alle brugere kunne se formålet med anvendelsen af et beslutningsstøtteværktøj, og 55% var fuldt ud tilfredse med dette (25).
Ved gennemgang af artiklerne om GS og STAR modellerne, var langt de fleste af studierne enten virtuelle studier, eller små pilotstudier, så selvom disse viste forbedret effekt i forhold til glykæmisk kontrol og opnåelse af ernæringsmål, var der endnu ikke udført RCT, der kunne dokumentere effekt på kliniske mål som mortalitet, komplikationer eller indlæggelsestid.
Ernæring: Giver rådgivning om justering og ernæringstype (ud fra tilgængelige ernæringsprodukter, Enteral, parenteral, proteintilskud, glucose ved hypoglykæmi osv.) både for at opnå de definerede ernæringsmål for patienten, samt opnå den bedst mulige glykæmiske kontrol. I kalorieregnskabet tages der hensyn til anden kalorieindgift i form af propofol- og glucoseinfusioner.
Blodsukker: Giver rådgivning om justering på intravenøs, hurtigtvirkende insulininfusion både kontinuerlig og/eller bolus (administrationsmetode vil ofte være afhængig af afdelings instrukser).
Implikationer for praksis
Ifølge litteraturgennemgangen var der udviklet modelbaserede beslutningsstøtteværktøjer til ernæringsterapi og glykæmisk kontrol, der både var testet i forhold til effekt og sikkerhed, samt i begrænset omfang også implementeret i klinisk drift. Når personalet blev guidet af disse værktøjer, opnåede patienterne både deres ernæringsmål samt et mere velreguleret blodsukker. Selvom der i studierne fremkom disse positive resultater, var det kun få af studierne, der belyste implementeringsprocessen og brugernes perspektiver på anvendelsen at teknologien.
Modelbaseret beslutningsstøtte til ernæringsterapi og glykæmisk kontrol, er kun et enkelt af de potentielle teknologiske redskaber til beslutningsstøtte på intensivafdelinger, der er under udvikling, herunder kan nævnes, volumenterapi (52) forudsigelser af tryksår (53), delir, akut nyreskade og genindlæggelser (54). Implementering af mange nye teknologier kan medføre risiko for, at sygeplejersker og læger ikke vil opleve teknologierne, som den hjælp de var tiltænkt, men i stedet opleve øget arbejdsbelastning og teknologierne som stressende (52).
Det er derfor afgørende for prioriteringen af sundhedsvæsnets ressourcer, at der laves teknologivurderinger inden de implementeres (55). Det kan gøres med udgangspunkt i Behandlingsrådets Metodevejledning, der omfatter en vurdering af teknologien med udgangspunkt i fire aspekter: Klinisk effekt og sikkerhed, Patientperspektiv, Organisatoriske implikationer og Sundhedsøkonomi (56). Som en del af en sådan teknologivurdering vil de organisatoriske implikationer omfatte undersøgelser af brugernes holdninger til- og oplevet behov for teknologien i en dansk kontekst, samt vurdering af ressourceforbrug til f.eks. undervisning i anvendelsen og tidsforbrug til blodsukkermålinger mv. sammenlignet med den eksisterende praksis.
Referencer
1. Syed M, Syed S, Sexton K, Syeda HB, Garza M, Zozus M, et al. Application of Machine Learning in Intensive Care Unit (ICU) Settings Using MIMIC Dataset: Systematic Review. Informatics 2021, Vol 8, Page 16 [Internet]. 2021 Mar 3 [cited 2023 Mar 18];8(1):16. Available from: https://www.mdpi.com/2227-9709/8/1/16/htm
2. Jacono FJ, de Georgia MA, Wilson CG, Dick TE, Loparo KA. Data acquisition and complex systems analysis in critical care: Developing the intensive care unit of the future. J Healthc Eng. 2010;1(3):337–55.
3. Vedantam D, Poman DS, Motwani L, Asif N, Patel A, Anne KK. Stress-Induced Hyperglycemia: Consequences and Management. Cureus [Internet]. 2022 Jul 10 [cited 2023 Feb 22];14(7). Available from: /pmc/articles/PMC9360912/
4. Berghe GV, Wouters P, Weekers F, Verwaest C, Bruyninckx F, Schetz M, et al. Intensive Insulin Therapy in Critically Ill Patients. https://doi.org/101056/NEJMoa011300 [Internet]. 2001 Nov 8 [cited 2023 Feb 22];345(19):1359–67. Available from: https://www.nejm.org/doi/full/10.1056/nejmoa011300
5. Angeli F, Reboldi G, Poltronieri C, Lazzari L, Sordi M, Garofoli M, et al. Hyperglycemia in acute coronary syndromes: From mechanisms to prognostic implications. Ther Adv Cardiovasc Dis [Internet]. 2015 Jul 19 [cited 2023 May 6];9(6):412–24. Available from: https://journals-sagepub-com.zorac.aub.aau.dk/doi/10.1177/1753944715594528
6. Mutrie L, Hill B. Providing nutritional support for patients in critical care. Nursing Standard. 2018 May;33(3):77–82.
7. Jacobi J, Bircher N, Krinsley J, Agus M, Braithwaite SS, Deutschman C, et al. Guidelines for the use of an insulin infusion for the management of hyperglycemia in critically ill patients. Crit Care Med [Internet]. 2012 Dec [cited 2023 Feb 23];40(12):3251–76. Available from: https://pubmed.ncbi.nlm.nih.gov/23164767/
8. Jensen AN, Andersen S, Skadhauge LB. Ernæringsinstruks for indlagte voksne patienter på intermediært afsnit (IMA). 2022.
9. Stjernholm PH. Ernæringsvejledning til kritisk syge patienter på Intensiv, Randers. Randers; 2020. Report No.: 7.
10. Buus L. Ernæring til intensive patienter. Horsens; 2021.
11. Svenstrup IJ. 7.11.4. Ernæring, ernæringsscreening, ernæringsplan og opfølgning. Viborg; 2021.
12. Winding RR. Ernæring til voksne kritisk syge patienter – ITBA OPI RHG. Gødstrup; 2022.
13. Illum DG. Ernæringsinstruks voksne, Intensiv. Aarhus; 2022.
14. Stjernholm PH. Insulinbehandling til kritisk syge patienter. Randers; 2015. Report No.: 3.
15. Buus L. Blodsukkerregulering på ITA. Horsens; 2022.
16. Sølling CG. 7.6.1 Blodsukkerinstruks. Viborg; 2021.
17. Intensiv RV. Blodsukkerregulering med refrakte doser insulin. Viborg; 2021.
18. Intensiv RV. Blodsukkerregulering med insulin-infusion. Viborg; 2021.
19. Nielsen BH. Insulinbehandling, opstartsalgoritme – ITBA OPI RHG. Gødstrup; 2022.
20. Nielsen BH. Insulinbehandling, reguleringsalgoritme – ITBA OPI RHG. Gødstrup; 2022.
21. Intensiv AUH. Blodsukkerregulering med refrakte doser insulin. Aarhus; 2021.
22. Nibro HL. Blodsukkerinstrusk, intensiv. Aarhus; 2021.
23. Intensiv AUH. Blodsukkerregulering med insulin-infusion. Aarhus; 2021.
24. Behzadi MT, Dalgaard CR. Insulinterapi og tæt blodsukkerkontrol hos kritisk syge patienter. 2023.
25. de Watteville A, Pielmeier U, Graf S, Siegenthaler N, Plockyn B, Andreassen S, et al. Usability study of a new tool for nutritional and glycemic management in adult intensive care: Glucosafe 2. J Clin Monit Comput [Internet]. 2021;35(3):525–35. Available from: https://www.embase.com/search/results?subaction=viewrecord&id=L2004582514&from=export
26. Pielmeier U, Andreassen S, Nielsen BS, Chase JG, Haure P. A simulation model of insulin saturation and glucose balance for glycemic control in ICU patients. Comput Methods Programs Biomed. 2010 Mar 1;97(3):211–22.
27. Pielmeier U, Chase JG, Andreassen S, Nielsen BS, Haure P, Shaw GM. Prediction Validation of Two Glycaemic Control Models in Critical Care. IFAC Proceedings Volumes. 2008 Jan 1;41(2):8074–9.
28. Pielmeier U, Rousing ML, Andreassen S, Nielsen BS, Haure P. Decision support for optimized blood glucose control and nutrition in a neurotrauma intensive care unit: Preliminary results of clinical advice and prediction accuracy of the Glucosafe system. J Clin Monit Comput [Internet]. 2012 Aug 13 [cited 2022 Dec 15];26(4):319–28. Available from: https://link-springer-com.zorac.aub.aau.dk/article/10.1007/s10877-012-9364-y
29. Rousing ML, Pielmeier U, Andreassen S. Stability of the insulin–glucose feedback loop in Glucosafe: A comparison of pancreas models. Biomed Signal Process Control. 2015 Sep 1;22:155–60.
30. Rousing ML, Pielmeier U, Andreassen S. Evaluating modifications to the Glucosafe decision support system for tight glycemic control in the ICU using virtual patients. Biomed Signal Process Control. 2014 Jul 1;12(1):54–61.
31. Rousing ML, Pielmeier U, Andreassen S. Virtual testing of decision support for tight glycemic control in the ICU. IFAC Proceedings Volumes. 2012 Jan 1;45(18):408–13.
32. Wong AF, Pielmeier U, Haug PJ, Andreassen S, Morris AH. An in silico method to identify computer-based protocols worthy of clinical study: An insulin infusion protocol use case. J Am Med Inform Assoc. 2016;23(2):283–8.
33. Pielmeier U, Andreassen S, Juliussen B, Chase JG, Nielsen BS, Haure P. The Glucosafe system for tight glycemic control in critical care: A pilot evaluation study. J Crit Care. 2010;25(1):97–104.
34. Marheineke N, Cibis TM, Schiessl S, Pielmeier U. Optimal control of glucose balance in ICU patients based on GlucoSafe model. J Math Ind [Internet]. 2014 Dec 15 [cited 2022 Dec 15];4(1):1–13. Available from: https://link.springer.com/articles/10.1186/2190-5983-4-3
35. Stewart KW, Pretty CG, Shaw GM, Chase JG. Creating smooth SI. B-spline basis function representations of insulin sensitivity. Biomed Signal Process Control. 2018;44:270–8.
36. Stewart KW, Pretty CG, Tomlinson H, Fisk L, Shaw GM, Chase JG. Stochastic Model Predictive (STOMP) glycaemic control for the intensive care unit: Development and virtual trial validation. Biomed Signal Process Control [Internet]. 2015;16:61–7. Available from: https://www.embase.com/search/results?subaction=viewrecord&id=L600362878&from=export
37. Penning S. Tight Glycaemic Control Model-based methods to answer critical questions about this controversial therapy [Thesis]. [Liege]: University og Liege; 2014.
38. Uyttendaele V, Knopp JL, Pirotte M, Morimont P, Lambermont B, Shaw GM, et al. STAR-Liège Clinical Trial Interim Results: Safe and Effective Glycemic Control for All. In: 2019 41st Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). IEEE; 2019. p. 277–80.
39. Ward L, Steel J, Le Compte A, Evans A, Tan CS, Penning S, et al. Interface design and human factors considerations for model-based tight glycemic control in critical care. J Diabetes Sci Technol. 2012;6(1):125–34.
40. Ward L, Steel J, Le Compte A, Evans A, Tan CS, Penning S, et al. Data entry errors and design for model-based tight glycemic control in critical care. J Diabetes Sci Technol. 2012;6(1):135–43.
41. Jamaludin UK, M. Suhaimi F, Abdul Razak NN, Md Ralib A, Mat Nor MB, Pretty CG, et al. Performance of Stochastic Targeted Blood Glucose Control Protocol by virtual trials in the Malaysian intensive care unit. Comput Methods Programs Biomed. 2018;162:149–55.
42. Razak AA, Abu-Samah A, Razak NNA, Jamaludin U, Suhaimi F, Ralib A, et al. Assessment of glycemic control protocol (STAR) through compliance analysis amongst malaysian ICU patients. Med Devices (Auckl). 2020;13:139–49.
43. Knopp JL, Chase JG, Shaw GM. The goldilocks problem: Nutrition and its impact on glycaemic control. Clin Nutr. 2021;40(6):3677–87.
44. Stewart KW, Pretty CG, Tomlinson H, Thomas FL, Homlok J, Noémi SN, et al. Safety, efficacy and clinical generalization of the STAR protocol: a retrospective analysis. Ann Intensive Care. 2016;6(1):24–24.
45. Davidson SM, Uyttendaele V, Pretty CG, Knopp JL, Desaive T, Chase JG. Virtual patient trials of a multi-input stochastic model for tight glycaemic control using insulin sensitivity and blood glucose data. Biomed Signal Process Control. 2020;59:101896.
46. Fisk LM, Le Compte AJ, Shaw GM, Penning S, Desaive T, Chase JG. STAR Development and Protocol Comparison. IEEE Trans Biomed Eng. 2012;59(12):3357–64.
47. CHASE JG, LE COMPTE AJ, PREISER JC, DESAIVE T, SUHAIMI F, SHAW GM, et al. Tight glycemic control in critical care – The leading role of insulin sensitivity and patient variability: A review and model-based analysis. Comput Methods Programs Biomed. 2011;102(2):156–71.
48. Chase J, Shaw G, Lotz T, LeCompte A, Wong J, Lin J, et al. Model-Based Insulin and Nutrition Administration for Tight Glycaemic Control in Critical Care. Curr Drug Deliv. 2007 Oct 1;4(4):283–96.
49. Cahill NE, Day AG, Cook D, Heyland DK. Development and psychometric properties of a questionnaire to assess barriers to feeding critically ill patients. Implementation Science [Internet]. 2013 Dec 4 [cited 2023 Mar 6];8(1):1–20. Available from: https://implementationscience.biomedcentral.com/articles/10.1186/1748-5908-8-140
50. Stewart KW, Chase JG, Pretty CG, Shaw GM. Nutrition delivery of a model-based ICU glycaemic control system. Ann Intensive Care. 2018;8(1):4–8.
51. Heidegger CP. GLUCOSAFE 2 – A New Tool for Nutritional Management and Insulin-therapy in the Intensive Care Unit (ICU) – Full Text View – ClinicalTrials.gov [Internet]. 2022 [cited 2023 Mar 17]. Available from: https://clinicaltrials.gov/ct2/show/NCT03890432
52. Kaltenhauser A, Rheinstädter V, Butz A, Wallach DP. You Have to Piece the Puzzle Together”: Implications for designing decision support in intensive care. DIS 2020 – Proceedings of the 2020 ACM Designing Interactive Systems Conference [Internet]. 2020 Jul 3 [cited 2023 Mar 19];1509–22. Available from: https://dl-acm-org.zorac.aub.aau.dk/doi/10.1145/3357236.3395436
53. Cho I, Park I, Kim E, Lee E, Bates DW. Using EHR data to predict hospital-acquired pressure ulcers: A prospective study of a Bayesian Network model. Int J Med Inform. 2013 Nov 1;82(11):1059–67.
54. D’Hondt E, Ashby TJ, Chakroun I, Koninckx T, Wuyts R. Identifying and evaluating barriers for the implementation of machine learning in the intensive care unit. Communications Medicine. 2022;2(1):162–12.
55. Om Behandlingsrådet [Internet]. [cited 2023 Mar 10]. Available from: https://behandlingsraadet.dk/om-behandlingsradet
56. Behandlingsrådets metodevejledning til evaluering af sundhedsteknologi. Aalborg Ø; 2021 Jun. (1). Report No.: 1.
Artiklen er redigeret af:














