Denne artikel blev første gang bragt i Dråben Danmark Nr. 4, december 2013, men bringes nu igen. Den kan med fordel læses i forlængelse af Tina Eldahl og Trine Vive’s artikel: Vågen sedation – der er forskel på sedation.
Skrevet af Louise Munk, Anæstesisygeplejerske og Egon Godthaab Hansen, Overlæge Anæstesiologisk Afdeling I, Herlev Hospital
I Danmark anvendes to typer α2-agonister (clonidin og dexmedetomidin), hvor clonidin længe har været kendt i behandlingen af tics ved tourettes syndrom, menopausale hedestigninger eller som migræneprofylakse. Først indenfor de seneste år har α2–agonisternes relative adrenerge specificitet givet anledning til brug i anæstesiologisk sammenhæng herunder som morfinbesparende middel, sedationsmiddel, adjuvans til regionale blokader og forebyggelse af postoperativ konfusion.
Denne artikel har til formål, at danne overblik over α2-agonisters farmakologiske styrker og svagheder og deres mulige kliniske, perioperative anvendelse.
Metode
Arbejdet er lavet på baggrund af en systematisk gennemgang af litteraturen i henholdsvis PubMed og Embase i perioden 17. juni-29. august 2013.
Søgningerne er foretaget ved brug af søgeordene:
Alpha-2 adrenergic agonist, Alpha-2 adrenoceptor, Adrenergic alpha-Agonists, Clonidin, Catapresan, Dexmedetomidine, Medetomidine, Sympathic nervous system, Premedication, Hemodynamics, Pharmacokinetic, Pharmacodynamic, Emergence agitation, Postoperative sleepiness, Anesthesia, Adrenergic alpha-1 Receptor Agonists
Der er foretaget manuel gennemgang af referencelister i de fundne artikler og nøgleartikler af såvel yngre som ældre data er fremskaffet og identificeret. Søgningerne er baseret på engelsksprogede reviews og RCT-studier, publiceret tilbage til og med 2008, omhandlende anæstesi til patienter i alle aldre. Vi har især interesseret os for stoffernes farmakodynamik og egnethed som anæstesimidler. Herunder de vigtigste administrationsveje, deres påvirkning af respiration, hæmodynamik, CNS samt sedative og analgetiske virkning.
Resultater
491 studier blev identificeret og kun de væsentligste RCT-studier, reviews og editorials er inkluderet. Gennemgangen er resulteret i 29 referencer. 2 af disse fokuserer på α2-adrenerge agonister, mens 18 fokuserer på brugen af dexmedetomidin og 9 på brugen af clonidin. En enkelt editorial beskæftigede sig med rekommandationer (1). Nævnte administrationsveje er intravenøse enten som bolus eller infusion, nasale, som adjuvans til regional anæstesi eller per os.
Farmakologi
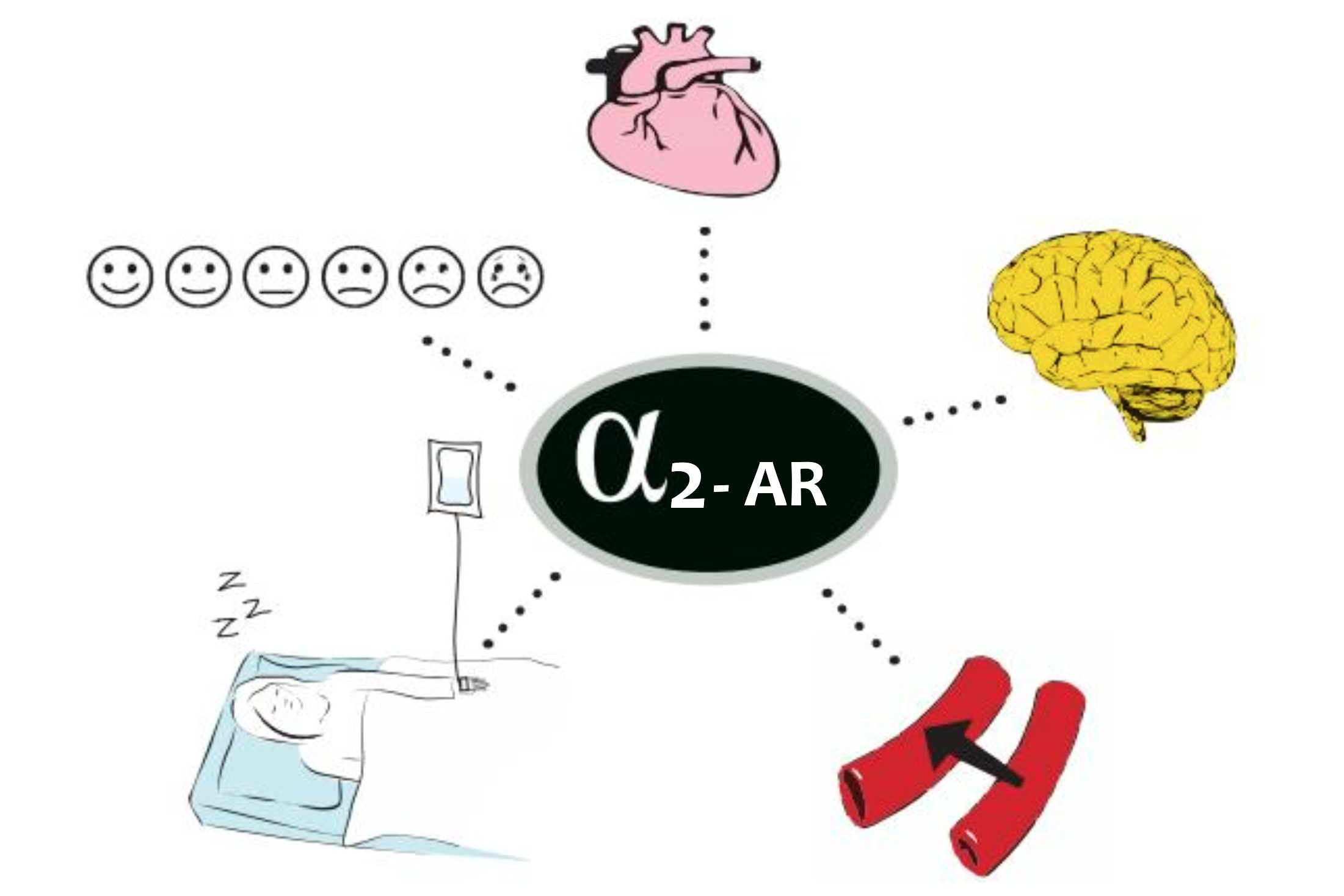
Farmakodynamik: α2-adrenerge receptorer (α2-AR) underinddeles i α2A-, α2B– og α2C-AR. De adskiller sig ved deres forskellige farmakologiske profiler og fordeling i vævene. Stimulation af α2-AR i hjerne og rygmarv hæmmer neural aktivitet og er årsag til hovedparten af de klassiske α2-AR-virkninger, herunder sedation, analgesi og sympatolyse (især bradykardi og hypotension).
Sympatolyse opstår når receptorerne, koncentreret i medulla stimuleres; sedation ved stimulation af receptorerne i øvre hjernestamme (locus ceruleus) og analgesi medieres ved stimuli af rygmarvens receptorer. Stimulation af α2B– AR, lokaliseret i glatmuskulaturen er baggrund for den forbigående hypertension, afledt af en systemisk α2-agonist-virkning (2, 3, 4). En respons der minimeres, når stoffet ikke bolus-administreres (5).

For dexmedetomidin er fald i puls og blodtryk dosisafhængigt (6), det virker hæmodynamisk stabiliserende og modvirker stress under kirurgi (7, 8, 9). Det samme gør sig gældende for clonidin (10, 11). Uhensigtsmæssige fald i puls og blodtryk forårsaget af dexmedetomidin behandles effektivt med efedrin, atropin og volumenterapi (5, 12). Præoperativ behandling med clonidin kan medføre postoperativ hypotension, og reducere det intraocculare tryk. Dette kan være formålstjenligt i relation til øjenkirurgi (13).
Uden samtidig indflydelse fra andre lægemidler, er dexmedetomidin beskedent anti-nociceptivt (5), men kraftigt synergistisk i konjunktion med selv små doser opioid, benzodiazepin, propofol eller anæstesigas (12).
Kombineret med traditionelle anæstesimidler, slår α2-agonisternes synergistiske effekt igennem på flere måder. Således ses en forlænget virkning af neuromuskulært blokerende stoffer som rocuron (14) og en tilsvarende kraftigere virkning og forlænget varighed af regionale blokader, når bupivacain tilsættes clonidin eller dexmedetomidin (15, 16, 17). Dette giver ingen signifikant påvirkning af postoperativ hæmodynamik eller sedation (12, 18).
Farmakokinetik: Dexmedetomidin er et nyere stof og blev først introduceret til klinisk praksis i starten af dette årtusinde. Stoffets specificitet for α2– AR er 7-8 gange stærkere end clonidins og dermed også langt mere potent end clonidin (3, 19).
Anslagstiden for dexmedetomidin er præget af stoffets fordelingshalveringstid på 6 minutter. Analogt med fentanyl er virkningen stærkt context sensitiv og halveringstiden strækker sig over 2 timer. Dexmedetomidin metaboliseres i leverens cytocrom p-450 system, elimineres via urinen og frembringer ingen aktive eller toksiske metabolitter (3, 5).
Klinisk anvendelse
Tiltagende popularitet: Siden 1990’erne er clonidin blevet tiltagende populært blandt udenlandske børneanæstetister. Stoffet har haft anvendelse som sedativ, som adjuvans til generelle anæstesimidler og regionale nerveblokader, til forebyggelse af agiteret opvågning efter anæstesi (18, 20, 21, 22, 23, 24) og mod postoperativ shivering (5).
Sedative egenskaber: Til forskel fra andre sedativa, adskiller α2-agonisterne sig på mindst to måder. For det første undertrykkes respirationen ikke ved klinisk relevante doser (4, 7). For det andet medfører stoffernes undertrykkelse af hjernestammens adrenerge aktivitet en neuromoduleret profil i lighed med naturlig søvn. Søvnkvaliteten adskiller sig i forhold til søvnen fremkaldt af GABA-midlerne (eksempelvis midazolam og propofol). Ved sedation med dexmedetomidin bevarer patienten således evnen til at kooperere, hvilket kan være fordelagtigt under intensiverede plejeprocedurer, røntgenprocedurer, anæstesiologisk luftvejshåndtering og i forbindelse med neurologiske tests under kraniotomier (12, 19, 25).
Præmedicinering: Ingen kendte α2-adrenerge agonister er undergruppeselektive og den primære brug af stofferne har traditionelt begrænset sig til hypertensionsbehandling (3). Med opdagelsen af deres potenserende egenskaber i forhold til traditionelle anæstesimidler, finder stofferne også anvendelse som præmedicineringsmidler, til intra- og perioperativ sedation og anxiolyse (26, 27).
Som præmedicinering har clonidin dog en række begrænsninger. En elimineringshalveringstid på 8 timer og en plasmakoncentration, der først peaker efter 60-90 minutter, gør at medikamentet bør indtages mindst en time forud for anæstesiinduktion. Dexmedetomidin der både er mere α2– AR-specifik, har kortere fordelingshalveringstid og halveringstid (5) er dermed mere velegnet til præmedicinering.
Anæstesimiddel besparende egenskaber: α2-agonisternes anæstesimiddel-besparende egenskaber i forhold til både intravenøse-, regionale- og gasformige anæstesimidler er også velkendte (23, 27). Det mindre forbrug af anæstesimidler kombineret med α2-agonisternes sympatolytiske virkning mindsker udsvingene i hæmodynamisk respons ved tracheal intubation og kirurgi for i stedet at øge tilbøjeligheden til bradykardi og hypotension (28).
Postoperativ restitution: Flere studier belyser effekten af α2-agonister på den postoperative restitution. Der er således evidens for at dexmedetomidin som perioperativt supplement til de vanlige anæstesimidler både reducerer det perioperative forbrug af opioider og anæstesigasser, og det postoperative behov for opioider, antiemetika og dermed indlæggelsestiden i opvågningsafdelingen (5, 15, 29).
Et reduceret forbrug af anæstesimidler viser sig endvidere særlig gavnligt for patienter med højt BMi og tendens til besværet respiration (5).
Diskussion
Sammenfattende byder de nævnte α2-agonister på en række interessante egenskaber set fra et anæstesiologisk perspektiv. For det første potenserer stofferne de gængse anæstesimidlers virkning, hvormed det peri- og postoperative forbrug mindskes og virkningen af regional anæstesi forlænges. For det andet har en reduktion i brugen af eksempelvis opioider indtil flere gavnlige effekter i det postoperative forløb. Herunder mindsket forekomst af opioidinducerede bivirkninger så som hyperalgesi, postoperativ kvalme og opkastning (PONV), agiteret opvågning og respirationsdepression. Tilstande der i værste fald kan være til fare for patienten, øge forbruget af personale ressourcer og/eller medvirke til forlænget indlæggelse.
α2-agonisternes egenskaber kan tænkes formålstjenlige hos patienter med øget følsomhed overfor brugen af de sædvanlige anæstesimidler. Herunder adipøse og bariatriske, respirationssvækkede, lungesyge og / eller hjertesyge patienter samt patienter med søvnapnø.
α-2 agonisternes anvendelse og langsigtede perspektiver indenfor anæstesien er dog fortsat uvisse. Derfor bør stoffernes potentielle fordele og ulemper overvejes grundigt før anvendelse. Udsigterne til en rekommandation af dexmedetomidin og en velegnet α2-receptor antagonist er endnu ikke indenfor rækkevidde.
Prisen for sedation med dexmedetomidin overstiger dog stadig de mere vanlige sedationsmidler betydeligt (30).
Key points
- α-2 agonisternes potentielle fordele skal vejes op mod deres cardiovaskulære påvirkning
- α-2 agonister har fortsat ingen rutinemæssig anvendelse i anæstesien
- Hos børn forbedrer α-2 agonister analgesi og forebygger agiteret opvågning. Balancen mellem fordele og ulemper er fortsat uafklaret
- Brugen af α-2 agonister kan være hensigtsmæssig hos særlige patientkategorier som patienter med søvnapnø, højt BMI eller dem med særlig følsomhed overfor vanlige anæstesimidler
- Regionalanæstesi tilsat clonidin eller dexmedetomidin, forlænger blokadens varighed uden at sedere eller give hæmodynamiske udsving
- Der er fortsat ingen internationale rekommendationer for anvendelsen af α-2 agonister i den perioperative medicin
Referencer
- Sleigh J. All hands on dex. Anaesthesia. 2012 Nov;67(11):1193-7
- Tobias JD, Gupta P, Naguib A, Yates AR. Dexmedetomidine: applications for the pediatric patient with congenital heart disease. Pediatr Cardiol. 2011 Dec;32(8):1075-87
- Chalikonda SA. Alpha2-adrenergic agonists and their role in the prevention of perioperative adverse cardiac events. AANA J. 2009 Apr;77(2):103-8
- Rocha AP, Barros GA, Nascimento Jdos S, Santos KP, Vasconcelos LM, Castro PA. Sedation with sufentanil and clonidine in patients undergoing heart catheterization. Arq Bras Cardiol. 2011 Mar;96(3):219-26
- Haselman MA. Dexmedetomidine: a useful adjunct to consider in some high-risk situations. AANA J. 2008 Oct;76(5):335-9
- El-Tahan MR, Mowafi HA, Al Sheikh IH, Khidr AM, Al-Juhaiman RA. Efficacy of dexmedetomidine in suppressing cardiovascular and hormonal responses to general anaesthesia for caesarean delivery: a dose-response study. Int J Obstet Anesth. 2012 Jul;21(3):222-9
- Apan A, Doganci N, Ergan A, Büyükkoçak U. Bispectral index-guided intraoperative sedation with dexmedetomidine and midazolam infusion in outpatient cataract surgery. Minerva Anestesiol. 2009 May;75(5):239-44
- Bekker A, Sturaitis M, Bloom M, Moric M, Golfinos J, Parker E, Babu R, Pitti A. The effect of dexmedetomidine on perioperative hemodynamics in patients undergoing craniotomy. Anesth Analg. 2008 Oct;107(4):1340-7
- Ayoglu H, Yapakci O, Ugur MB, Uzun L, Altunkaya H, Ozer Y, Uyanik R, Cinar F, Ozkocak I. Effectiveness of dexmedetomidine in reducing bleeding during septoplasty and tympanoplasty operations. J Clin Anesth. 2008 Sep;20(6):437-41
- Paris A, Kaufmann M, Tonner PH, Renz P, Lemke T, Ledowski T, Scholz J, Bein B. Effects of clonidine and midazolam premedication on bispectral index and recovery after elective surgery. Eur J Anaesthesiol. 2009 Jul;26(7):603-10
- Pandazi A, Karamanis P, Sidiropoulou T, Matsota P, Papasideris C, Niokou D, Kostopanagiotou G. Low-dose (1 microg/kg) clonidine premedication and hypotension after carotid artery surgery. Vasc Endovascular Surg. 2011 Oct;45(7):614-8
- Saadawy I, Boker A, Elshahawy MA, Almazrooa A, Melibary S, Abdellatif AA, Afifi W. Effect of dexmedetomidine on the characteristics of bupivacaine in a caudal block in pediatrics. Acta Anaesthesiol Scand. 2009 Feb;53(2):251-6
- Zeraatian S, Zakeri H, Boroojeny SB, Hourang MH, Ghaffarpasand F, Fard MM. Effect of oral clonidine on acute intraocular pressure rise after phacoemulsification: a prospective double-blind, randomized, clinical trial. J Ocul Pharmacol Ther. 2011 Jun;27(3):293-7
- Ozcan A, Ozcan N, Gulec H, Yalcin F, Basar H. Comparison of the effects of fentanyl, remifentanil, and dexmedetomidine on neuromuscular blockade. J Anesth. 2012 Apr;26(2):196-9
- Xiang Q, Huang DY, Zhao YL, Wang GH, Liu YX, Zhong L, Luo T. Caudal dexmedetomidine combined with bupivacaine inhibit the response to hernial sac traction in children undergoing inguinal hernia repair. Br J Anaesth. 2013 Mar;110(3):420-4
- Mohamed AA, Fares KM, Mohamed SA. Efficacy of intrathecally administered dexmedetomidine versus dexmedetomidine with fentanyl in patients undergoing major abdominal cancer surgery. Pain Physician. 2012 Jul-Aug;15(4):339-48
- Disma N, Frawley G, Mameli L, Pistorio A, Alberighi OD, Montobbio G, Tuo P. Effect of epidural clonidine on minimum local anesthetic concentration (ED50) of levobupivacaine for caudal block in children. Paediatr Anaesth. 2011 Feb;21(2):128-35
- Ghosh SM, Agarwala RB, Pandey M, Vajifdar H. Efficacy of low-dose caudal clonidine in reduction of sevoflurane-induced agitation in children undergoing urogenital and lower limb surgery: a prospective randomised double-blind study. Eur J Anaesthesiol. 2011 May;28(5):329-33
- Chrysostomou C, Schmitt CG. Dexmedetomidine: sedation, analgesia and beyond. Expert Opin Drug Metab Toxicol. 2008 May;4(5):619-27.
- Lili X, Jianjun S, Haiyan Z. The application of dexmedetomidine in children undergoing vitreoretinal surgery. J Anesth. 2012 Aug;26(4):556-61
- Dahmani S, Brasher C, Stany I, Golmard J, Skhiri A, Bruneau B, Nivoche Y, Constant I, Murat I. Premedication with clonidine is superior to benzodiazepines. A meta analysis of published studies. Acta Anaesthesiol Scand. 2010 Apr;54(4):397-402
- Talon MD, Woodson LC, Sherwood ER, Aarsland A, McRae L, Benham T. Intranasal dexmedetomidine premedication is comparable with midazolam in burn children undergoing reconstructive surgery. J Burn Care Res. 2009 Jul-Aug;30(4):599-605
- Ghosh I, Bithal PK, Dash HH, Chaturvedi A, Prabhakar H. Both clonidine and metoprolol modify anesthetic depth indicators and reduce intraoperative propofol requirement. J Anesth. 2008;22(2):131-4
- Mizrak A, Karatas E, Saruhan R, Kara F, Oner U, Saricicek V, Baysal E. Does dexmedetomidine affect intraoperative blood loss and clotting tests in pediatric adenotonsillectomy patients? J Surg Res. 2013 Jan;179(1):94-8
- Farag E, Argalious M, Abd-Elsayed A, Ebrahim Z, Doyle DJ. The use of dexmedetomidine in anesthesia and intensive care: a review. Curr Pharm Des. 2012;18(38):6257-65
- Yuen VM, Hui TW, Irwin MG, Yuen MK. A comparison of intranasal dexmedetomidine and oral midazolam for premedication in pediatric anesthesia: a double-blinded randomized controlled trial. Anesth Analg. 2008 Jun;106(6):1715-21
- Blaudszun G, Lysakowski C, Elia N, Tramèr MR. Effect of perioperative systemic α2 agonists on postoperative morphine consumption and pain intensity: systematic review and meta-analysis of randomized controlled trials. Anesthesiology. 2012 Jun;116(6):1312-22
- Talebi K, Nourozi A, Fateh S, Mohammadzadeh A, Eghtesadi-Araghi P, Jabbari S. Effects of Oral Clonidine Premedication oh Haemodynamic Response to Laryngoscopy and Tracheal Intubation: A Clinical Trial. Pak J Biol Sci. 2010 Dec 1;13(23):1146-50
- Tufanogullari B, White PF, Peixoto MP, Kianpour D, Lacour T, Griffin J, Skrivanek G, Macaluso A, Shah M, Provost DA. Dexmedetomidine infusion during laparoscopic bariatric surgery: the effect on recovery outcome variables. Anesth Analg. 2008 Jun;106(6):1741-8
- Pro.medicin, information til sundhedsfaglige: https://pro.medicin.dk/Laegemiddelgrupper/Grupper/318427
Summary
Alpha-2-agonists (α2-agonists) were introduced in human clinical practice approximately 20 years ago. Clonidine is currently the only α2-agonist used clinically in anesthesia in Denmark, despite α2-agonists being long known to have anesthesia-sparing, sedative, anxiolytic and analgetic properties.
Many studies have published throughout the years to define the role of these unique agents. However, their routine use is limited due to an incidence of undesirable effects and as a consequence, an international recommendation is still not available for the routine use of α2-agonists in the perioperative setting.
Keywords: Clonidine, dexmedetomidine, anesthesia, analgesia, sedation, anxiolytic, postoperative agitation.